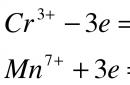Название:
Основы аналитической химии. Практическое руководство
Золотов Ю.А.
Год издания:
2001
Размер:
9.29 МБ
Формат:
djvu
Язык:
Русский
"Основы аналитической химии. Практическое руководство" под ред., Золотова Ю.А., является дополнительным пособием к двум книгам по аналитической химии этого автора. Книга содержит незначительную теоретическую часть. Описаны возможности анализа, его методики. Руководство содержит практические работы по курсу предмета. Для студентов-фармацевтов.
Название:
Фармацевтичний аналіз
Безуглий П.О.
Год издания:
2001
Размер:
2.82 МБ
Формат:
pdf
Язык:
Украинский
Описание:
Учебное пособие "Фармацевтичний аналіз" под ред., Безуглого П.О., рассматривает методики фармацевтического анализа медикаментов различными способами, используя физико-химические и химические методы. П... Скачать книгу бесплатно
Название:
Аналитическая химия в схемах и таблицах
Болотов В.В., Жукова Т.В., Микитенко Е.Е.
Год издания:
2002
Размер:
1.21 МБ
Формат:
pdf
Язык:
Русский
Описание:
Справочное пособие "Аналитическая химия в схемах и таблицах" под ред., Болотова В.В., и соавт., рассматривает практические вопросы количественного и качественного анализа. Представлены материалы о гет... Скачать книгу бесплатно
Название:
Конспект лекций по аналитической химии (количественный анализ)
Год издания:
2002
Размер:
1.47 МБ
Формат:
pdf
Язык:
Русский
Описание:
Практическое пособие "Конспект лекций по аналитической химии (количественный анализ)" под ред., Болотова В.В., рассматривает в виде лекционного материала основы количественного анализа используемого х... Скачать книгу бесплатно
Название:
Конспект лекций по аналитической химии (качественный анализ)
Болотов В.В., Дынник Е.В., Жукова Т.В.
Год издания:
2002
Размер:
1.56 МБ
Формат:
pdf
Язык:
Русский
Описание:
Практическое пособие "Конспект лекций по аналитической химии (качественный анализ)" под ред., Болотова В.В., рассматривает в виде лекционного материала основы качественного анализа используемого химич... Скачать книгу бесплатно
Название:
Аналитическая химия. Проблемы и подходы. Том 2
Кельнер Р., Мерме Ж.
Год издания:
2004
Размер:
8.45 МБ
Формат:
djvu
Язык:
Русский
Описание:
Практическое руководство "Аналитическая химия. Проблемы и подходы" под ред., Кельнера Р., и соавт., рассматривает актуальные вопросы аналитики в химии, фармации. Книга состоит из двух томов. Второй со... Скачать книгу бесплатно
Название:
Аналитическая химия. Проблемы и подходы. Том 1
Кельнер Р., Мерме Ж.
Год издания:
2004
Размер:
11.62 МБ
Формат:
djvu
Язык:
Русский
Описание:
Практическое руководство "Аналитическая химия.Проблемы и подходы" под ред., Кельнера Р., и соавт., рассматривает актуальные вопросы аналитики в химии, фармации. Книга состоит из двух томов. Первый сод... Скачать книгу бесплатно
Название:
Аналитическая химия. Практикум
Год издания:
2009
Размер:
11.45 МБ
Формат:
pdf
Язык:
Русский
Описание:
Учебное пособие "Аналитическая химия. Практикум" под ред.. Харитонова Ю.Я., и соавт., рассматривает данные о характеристиках и видах качественного анализа различных химических элементов (анионов, кати... Скачать книгу бесплатно
Название:
Примеры и задачи по аналитической химии
Харитонов Ю.Я., Григорьева В.Ю.
Год издания:
2008
Размер:
145.97 МБ
Формат:
pdf
Язык:
Русский
Описание:
Учебное пособие "Примеры и задачи по аналитической химии" под ред., Харитонова Ю.Я., и соавт., рассматривает тематические задачи по тематикам курса аналитической химии. Присутствуют задачи с решениями...
Практикум состоит из трех частей. Первая часть содержит общие сведения о технике безопасности и правилах работы в химической лаборатории, основных приемах работы с химической посудой и реактивами, проведении основных химико-аналитических операций и метрологии анализа. Вторая часть представляет собой описание 50 работ лабораторного практикума по химическим методам анализа. Третья часть посвящена физико-химическим методам анализа. Изложены основы и техника выполнения 75 работ с применением приборов отечественного производства. Для студентов вузов, обучающихся по направлениям подготовки дипломированных специалистов химико-технологического профиля. Может быть использован студентами энергетических, сельскохозяйственных, медицинских, металлургических, педагогических и других вузов, а также сотрудниками заводских и экологических лабораторий.
На нашем сайте вы можете скачать книгу "Аналитическая химия. Лабораторный практикум" Васильев Владимир Германович бесплатно и без регистрации в формате fb2, rtf, epub, pdf, txt, читать книгу онлайн или купить книгу в интернет-магазине.
Рассмотрено и одобрено на заседании кафедры «Технических и естественнонаучных дисциплин» филиала МГУТУ в г. Калуге
Протокол от «___» _____________ 200_ г.
Зав. кафедры Глухова Н.А.
Старший преподаватель Кривова Ю.С.
Рецензент: к.с.х.н., доцент Коробкова О.И.
Пояснительная записка
Рабочая тетрадь предназначена для выполнения лабораторных работ и самоконтроля знаний по дисциплине «Аналитическая химия», рассматриваются следующие темы: «Титрование», «Фотоколориметрия», «Рефрактометрия» и «Потенциометрия».
Также студентам предлагается ответить на вопросы тестовых заданий. При ответе на вопрос теста студенту необходимо вписать правильный ответ в бланк для ответов. В случае получения неудовлетворительного результата студентам необходимо проработать материал с использованием литературы.
При выполнении эксперимента студентам необходимо занести в тетрадь наблюдения, вычисления по работе, построить графики, схемы и уравнения реакций и выводы.
Лабораторная работа № 1
Приготовление первичного стандартного раствора щавелевой кислоты H 2 C 2 О 4 · 2Н 2 О
Стандартный раствор готовят из химически чистой щавелевой кислоты. Молярную массу эквивалента щавелевой кислоты рассчитывают, исходя из реакции взаимодействия с гидроксидом натрия, протекающей по уравнению:
H 2 C 2 О 4 + 2NaOH = Na 2 C 2 О 4 + 2Н 2 О
H 2 C 2 О 4 + 2OH – = C 2 О 4 – + 2Н 2 О
Из уравнения следует:
Расчет навески для приготовления первичного стандартного раствора ведут по формуле:
Ход работы
Рассчитанную навеску щавелевой кислоты взвешивают в боксе сначала на технических весах, а затем точно на аналитических весах. Навеску через воронку количественно переносят в мерную колбу, растворяют в дистиллированной воде, добавляют воды до метки и тщательно перемешивают.
2. Протокол работы
1.1. Масса пустого бюкса на технических весах
1.2. Масса пустого бюкса на аналитических весах
1.3. Масса бюкса с навеской на технических весах
1.4. Масса бюкса с навеской на аналитических весах
1.5. Масса навески
3. Расчет результатов работы
3.1. 2 C 2 О 4 · 2Н 2 О
3.2. Расчет титра H 2 C 2 О 4 · 2Н 2 О
3.3. Расчет поправочного коэффициента
Вывод: приготовлен раствор первичного стандарта H 2 C 2 О 4 · 2Н 2 О по точной навеске с K = _____ к 0,1 н. раствору.
Лабораторная работа № 2
Определение содержания серной кислоты
Реагенты : Щавелевая кислота H 2 C 2 О 4 · 2Н 2 О; 0,1н раствор (первичный стандарт).
Гидроксид натрия NaOH (или калия КОН); 0,1н раствор (вторичный стандарт, титрант).
Индикатор - фенолфталеин.
I. Установление концентрации раствора NaOH
Концентрацию (С, Т) NaOH устанавливают по первичному стандартному раствору исходного вещества, например, по щавелевой кислоте.
Ход работы
Бюретку тщательно промывают водой и ополаскивают приготовленным раствором NaOH; затем, подставив под неё стакан, открывают зажим и заполняют раствором оттянутый кончик бюретки, чтобы в нем не осталось пузырьков воздуха. Устанавливают уровень NaOH в бюретке на нуле.
Мерную пипетку ополаскивают стандартным раствором щавелевой кислоты, после чего отмеряют 10 мл его и переносят в коническую колбу; прибавляют 2 – 3 капли фенолфталеина и титруют при непрерывном помешивании раствором NaOH до появления бледно-розовой окраски, не исчезающей около 30 секунд.
При этом протекает реакция по уравнению:
H 2 C 2 O 4 + NaOH = Na 2 C 2 O 4 + 2H 2 O
Титрование проводят не менее трех раз до получения сходящихся результатов (+/ – 0,1мл).
2. Протокол работы
2.1. Объём раствора щавелевой кислоты взятый для титрования
2.2. Объём раствора щелочи, пошедший на первое титрование
2.3. Объём раствора щелочи, пошедший на второе титрование
2.4. Объём раствора щелочи, пошедший на третье титрование
2.5. Средний объём раствора щелочи
3. Расчет результатов работы
3.1. Расчет молярной концентрации эквивалента щелочи:
3.2. Расчет титра гидроксида натрия:
3.3. Расчет поправочного коэффициента:
Вывод: установлена точная концентрация NaOH с K = _____ к 0,1н.
II. Определение содержания серной кислоты в растворе
Ход работы
Полученный объём анализируемого раствора серной кислоты в мерной колбе доводят дистиллированной водой до метки и тщательно перемешивают. Мерную пипетку ополаскивают приготовленным раствором серной кислоты, отбирают 10 мл этого раствора в коническую колбу и добавляют 2–3 капли фенолфталеина.
Титрант – раствор гидроксида натрия NaOH – наливают в бюретку и устанавливают уровень раствора на нуле, заполнив кончик бюретки. Раствор серной кислоты титруют при перемешивании раствором NaOH до появления, неисчезающей в течение 30 сек. бледно-розовой окраски. Титрование повторяют 2–3 раза.
2. Протокол работы
2.1. Объём раствора H 2 SO 4 , взятый для титрования.
2.2. Объём раствора NaOH, пошедший на первое титрование
2.3. Объём раствора NaOH, пошедший на второе титрование
2.4. Объём раствора NaOH, пошедший на третье титрование
2.5. Средний раствор объём щелочи
3. Расчет результатов работы
3.1. Расчет молярной концентрации эквивалента H 2 SO 4
3.2. Расчет титра гидроксида натрия по серной кислоте
3.3. Содержание (масса) H 2 SO 4 в объёме мерной колбы:
Вывод:
Лабораторная работа № 3
Фотоколориметрическое определение железа в винах с помощью роданида калия
Ход работы
1. Приготовление растворов с известной концентрацией железа
Для построения градуированного графика в четыре мерные колбы на 100 см вносят 5 , 10 , 15 , 20 см HNО 3 , по 6 капель 30% Н 2 О 2 , по 40 см 3 5% раствора KSCN и доводят дистиллированной водой до метки.
2. Определение оптической плотности растворов
Спустя 30 минут по завершению химических реакций, измеряют абсорбционность каждого из растворов на приборе с зелёным светофильтром в кюветах с толщиной слоя 10 мм. В одну кювету наливают раствор фона, а в другую кювету - раствор с содержанием железа 100 мкг и измеряют абсорбционность (оптическая плотность).
Каждое определение следует повторить 3 раза. Далее, меняя раствор во второй кювете, находят абсорбционность для растворов с содержанием железа 200, 300, 400 мкг.
Результаты определения заносят в таблицу 1.
Таблица 1.
Взято стандартного раствора, см 3 | стандартном растворе, мкг |
среднее |
0,02 | 0,02 | 0,02 | 0,02 |
0,05 | 0,05 | 0,05 | 0,05 |
0,11 | 0,11 | 0,11 | 0,11 |
0,17 | 0,17 | 0,17 | 0,17 |
3. Построение градуировочной кривой
На основании полученных данных строят градуировочную кривую. На ось абсцисс откладывают содержание железа в мкг, а на оси ординат - А.
Анализ вина
4. Приготовление раствора вина
Для определения железа готовят раствор вина. В мерную колбу на 100 см 3 берут 20 см 3 вина, 2 см 3 HNО 3 , 6 капель 30% Н 2 О 2 , 40 см 5% раствора KSCN и доводят содержимое колбы до метки дистиллированной водой. Затем измеряют А - абсорбционность исследуемого вина и по градуировочной кривой определяют содержание железа в растворе ("С" мкг).
5. Определение содержания железа в вине
Вывод:
Лабораторная работа № 4
Определение сахара рефрактометрическим методом (инструкция)
Метод заключается в рефрактометрическом определении сахара в растворе кофе, какао предварительным осаждением белков молока.
Приборы: универсальный рефрактометр РЛУ.
Посуда: химический стакан, пробирки.
Реактивы: 12 % раствор уксусной кислоты, фильтровальная бумага.
Ход работы
В химический стакан помешают 10 мл кофе или какао. Для осаждения белков добавляют 6 капель 12 % уксусной кислоты (до выпадения крупных хлопьев, рН должен быть равен 5). Раствор фильтруют через сухой складчатый фильтр в сухую пробирку. Затем в фильтрате определяют показатель преломления при 20 о С. Определение проводят не менее двух раз. Для расчета используют среднеарифметическую величину. Параллельно определяют показатель преломления дистиллированной воды.
Расчет
Формула для расчета:
С % - содержание сахара в %.
n - показатель преломления испытуемого раствора
n′ - показатель преломления дистиллированной воды
К - коэффициент пересчета показателя преломления на содержание сахара.
1000 - множитель для выражения результата целым числом.
Вывод:
Лабораторная работа № 5
Определение сухих веществ в соке
Приборы: рефрактометр ИРФ - 22.
Посуда: 1. Стаканчик емкостью 100 см.
2. Стеклянная палочка.
3. Пипетка.
4. Пробирки.
1. Подготовка прибора (проверка нулевой точки)
Перед началом работы раскрывают призмы измерительной головки. Рабочие поверхности промывают дистиллированной водой и высушивают фильтровальной бумагой. Проверяют правильность установки шкалы по дистиллированной воде n = 1,3330.
Для этого наносят на измерительную призму стеклянной палочкой 2-3 капли дистиллированной воды и осторожно опускают на нее осветительную призму. Поворотом зеркала направляют световой поток от источника света в окно осветительной призмы и через окуляр наблюдают появление равномерно освещенного поля.
Затем, осторожно поворачивая рукоятку, точно совмещают границу раздела с перекрестием зрительной трубы и снимают отчет по шкале показателей преломления. На левой шкале коэффициент преломления должен быть равен 1,333, а на правой шкале - % сухих, равный 0 (нулю).
2. Ход работы
Две - три капли исследуемого раствора сока поместить на измерительную призму, осторожно разровнять. Добиться четкой границы светотени: если наблюдается спектр, то необходимо его убрать, вращая компенсатор. Затем совмещают границу светотени с визирной линией и отсчитывают показатель преломления по шкале. Затем сдвигают границу светотени и снова совмещают и отсчитывают показатель преломления. Таким образом, проводят 3-5 отсчетов, после чего находят среднее арифметическое. По окончании работы рабочие поверхности призм тщательно вытирают, промывают спиртом, затем снова вытирают.
Сравниваем полученный результат с таблицей показателей преломления и содержанием сухих веществ в стандартных растворах.
Вывод:
Лабораторная работа № 6
Определение активной кислотности сока, вина, мучной болтушки
Определение кислотности вин и соков потенциометрическим методом имеет большое значение для пищевой технологии.
Все кислоты в водных растворах распадаются (диссоциируют) на ионы водорода и кислотного остатка. Так сильные кислоты (H 2 SО 4 , HCI) диссоциируют почти полностью с высокой степенью диссоциации, а слабые (винная, лимонная, яблочная, уксусная и др.) в очень малой степени, чаще выражаемой константой диссоциации.
Для сильных кислот в водных растворах диссоциация практически необратима:
HCI ↔ Н + + Сl - или Н 2 О + H + → Н з О +
α (степень диссоциации) = (число распавшихся молекул ∙ 100%) / общее число молекул
Для слабых кислот диссоциация обратима (равновесие):
СН з СООН ↔ H + + СН з СОО -
В отличие от общей титруемой кислотности , обуславливаемой совместным присутствием сильных и слабых кислот в вине, соке, активная кислотность выражается концентрацией лишь сильных диссоциированных кислот и определяется непосредственно как рН объекта.
Активная концентрация сильных кислот, выражаемая рН, оказывает влияние на степень кислотности («силу кислотного вкуса») вина и соков гораздо больше, чем даже высокое содержание слабых кислот.
Из слабых кислот (лимонная, яблочная и др.) наибольшей кислотностью обладает винная кислота.
рН вина, выражающий его активную кислотность, определяют по показаниям потенциометра (рН - метра) ЛПУ - 01.
Потенциометр включён в общую схему с электродами стеклянным (1 рода) и хлорсеребряным (2 рода), погружаемыми в образец исследуемого вина.
1. Ход работы
Приборы: потенциометр (рН - метр) ЛПУ - 01, электроды хлорсеребряный (сравнения) и стеклянный (индикаторный). Посуда: стаканчик на 50 см 3 , мерный цилиндр на 50 см 3 .
Реактивы: буферный раствор, рН = 4,01
2. Подготовка прибора
Включают рН - метр тумблером «З» в электросеть и после 30 мин, прогревания настраивают шкалу рН (верхняя шкала прибора) по буферному раствору с рН около 4 (для кислотного диапазона).
3. Техника определения
Электроды промывают дистиллированной водой, следы её удаляют фильтровальной бумагой и погружают электроды в стакан на 50 см 3 со стандартным буферным раствором; переключатель «виды работ» устанавливают в положении «рН», переключатель пределов измерения устанавливают на диапазон рН 2-6.
Рукояткой «Настройка по буферному раствору» устанавливают стрелку шкалы на значение рН стандартного буферного раствора (например, рН = 4,01) и проверяют устойчивость показаний в диапазоне 2-14 рН.
Затем выливают буферный раствор, промывают электроды и стакан дистиллированной водой, ополаскивают их образцом исследуемого вина, наливают 25 см 3 вина в стакан и погружают электроды. Вначале устанавливают переключателем пределов измерения на широкий диапазон измерения рН 2 -14, приблизительно оценивают значение рН по показаниям стрелки и после установки переключателем узкого диапазона рН 2 - 6 фиксируют точное значение рН.
Вывод:
Тест самоконтроля по теме:
I вариант I уровень
1. Какие ионы одновременно могут находиться в растворе:
1.Fe 2+ и CI - 2. Fe 2+ и OH - 3. Fe 3+ и 3- 4. Fe 3+ и SO 4 2-
2. Какое вещество переведет Bi (OH) 2 NO 3 в среднюю соль:
1. NaOH 2. HNO 3 3. Ca(NO 3 ) 2 4. KOH
3.Укажите соль, водный раствор которой имеет нейтральную реакцию:
1. NH 4 CI 2. CH 3 COONa 3. MgCl 2 4.NaCl
4. В растворе концентрация гидроксид - ионов равна 10 -8 моль-ион/л.
Какая среда этого раствора:
1. не изменится 2. уменьшится 3. увеличится
6. рН раствора соли, образованной катионом слабого основания и анионом слабой кислоты, будет:
1. рН > 7 2. рН
7. рН раствора соляной кислоты равен 2, чему равна молярная концентрация этого раствора:
1. 0,01 моль/дм 3 2. 0,02 моль/дм 3 3. 0,2 моль/дм 3
8. рН раствора слабой кислоты рассчитывают по формуле:
1. pH = - lg C кис. 2. pH = 14 – lg C осн. 3. рН = ½ рК кис – ½ lg Скис.
9. Буферный раствор представляет собой сопряженную пару. Допишите соль в ацетатном буферном растворе:
1. NH 4 CI 2. CH 3 COONa 3. Na 2 HPO 4
10. К раствору, содержащему Pb(NO 3 ) 2 прилили K 2 S и KOH одинаковой концентрации. Какой осадок выпадает в первую очередь.
1. PbS (ПР PbS = 8,7 · 10 -29 ) 2. Pb(OH) 2 (ПР Pb(OH) 2 = 2,1 · 10 -14 )
I вариант II уровень
11. Какие пары веществ прореагируют в водных растворах:
1. BaCI 2 и CuSO 4 2. KCI и CuSO 4 3. MgCl 2 и CuSO 4 4. MgSO 4 и Ba(NO 3 ) 2
12. рН 0,01 н раствора КОН равен:
1. 2 2. 10 3. 12
13. На раствор, содержащий 0,1 моль/л ионов бария и 0,001 моль/л ионов кальция, подействовали избытком раствора серной кислоты. Какая из солей образуется в первую очередь? (ПР BaSO 4 = 1,8 10 -10 ПР CaSO 4 = 3,7 10 -5 )
1. BaSO 4 2. CaSO 4
14. Выпадает ли осадок BaCO 3 , если концентрация ионов бария равна 5,1·10 -3 моль/л, а концентрация карбонат ионов равна 6,22 · 10 -3 моль/л (ПР BaCO 3 = 4,9 ·10 -9 ).
1. да 2. нет
15. Вычислить рН раствора, содержащего 1,00 г. соляной кислоты в 1 л. раствора.
1. 0,27 2. 0,57 3. 1 4. 1,43
Тест самоконтроля по теме:
«Теоретические основы аналитической химии»
II вариант I уровень
1. В каком случае пойдет реакция между ионами:
1. Ba 2+ и CI - 2. Ba 2+ и SO 4 2- 3. Ba 2+ и NO 3 -
2. С помощью какого вещества можно перевести AI (OH)CI 2 в среднюю соль:
1. NaOH 2. NaCl 3. Al(OH) 3 4. HCl
3. Укажите соль, раствор которой имеет щелочную среду:
1. Cu(NO 3 ) 2 2. NaCl 3. Na 2 S 4. ZnCl 2
4. В растворе концентрация ионов водорода = 10 -8 моль-ион/л.
Какая среда этого раствора:
1. нейтральная 2. щелочная 3. кислая
5. Раствор кислоты или щелочи добавили в воду, если рН стало > 7.
1. кислоты 2. щелочи
6. рН раствора соли, образованной анионом слабой кислоты и катионом сильного основания будет:
1. рН > 7 2. рН = 7 3. рН
7. рОН раствора едкого калия равен 3. Чему равна молярная концентрация этого раствора:
1. 0,001 моль /дм 3 2. 0,003 моль /дм 3 3. 0,030 моль /дм 3
8. рОН раствора слабого основания рассчитывают по формулам:
1. рОН = 14 - lg С кис 2. рОН = ½ pК осн – ½ lg С осн 3. рОН = - lg С осн
9. Буферные растворы – это растворы, рН которых практически не меняется при разведении и при добавлении небольших количеств кислот и щелочей. Указать рН аммонийного буферного раствора:
1. рН = 7 2. рН = 4,7 3. рН = 9,3
10. К раствору, содержащему FeSO 4 , прилили сульфат натрия и гидроксид натрия одинаковой концентрации. Какой осадок выпадает в первую очередь: